尽管蛋白质组学已为我们提供了细胞中蛋白表达的全景图谱,但仅有蛋白表达量信息,远不足以解释生命系统的动态调控行为。蛋白质的功能状态,并不简单由其表达水平所决定,而是高度依赖于翻译后所发生的共价修饰事件,即所谓的翻译后修饰(Post-Translational Modifications, PTMs)。这些修饰包括酶促或非酶促地将化学基团(如磷酸、乙酰、甲基、泛素等)添加至特定氨基酸残基,从而调控蛋白质的构象、酶活性、稳定性、亚细胞定位及其与其他生物大分子的相互作用。
当前已有研究表明,超过80%的功能性蛋白质在体内处于某种翻译后修饰状态,其中许多修饰具备动态性、可逆性和时空特异性,可在数秒至分钟的尺度内响应外界刺激。例如,细胞信号转导过程中激酶和磷酸酶的协同作用,可实现对信号级联的放大与反馈调控;而泛素-蛋白酶体系统通过多聚泛素链型的差异,构建出复杂的降解选择性和非降解性信号传导通路。更重要的是,多个修饰往往并非独立发生,而是呈现“串扰(crosstalk)”关系,通过互作、竞争、协同等模式在蛋白质表面构建出高度复杂的“修饰码(PTM code)”,对细胞命运决策与功能分化具有深远影响。
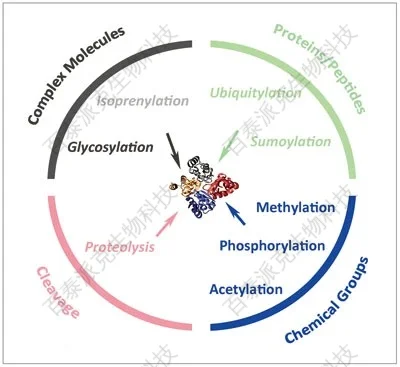
Cell Res 24, 143–160 (2014)
真核细胞中多种可逆和不可逆的蛋白质翻译后修饰 (PTM) 机制
在系统生物学视角下,PTMs被认为是连接基因型与表型之间的关键桥梁,代表了除表达量之外的第四层调控逻辑。其研究不仅为我们揭示细胞信号网络、表观遗传调控与应激应答等过程的精细机制,也为疾病机制解析、药物靶点筛选与临床标志物发现提供了关键突破口。近年来,新型修饰(如乳酸化、羟丁酰化、谷胱甘肽化等)的陆续发现进一步拓展了我们对代谢-表观-信号联通性的理解,表明PTMs是理解生命系统复杂性的核心切入点之一。
常见的翻译后修饰类型
蛋白质翻译后修饰(PTMs)涵盖数百种不同的化学修饰类型,其中一些在进化中高度保守,另一些则仅限于特定生理状态或特定物种。它们主要发生在蛋白质链的侧链官能团上(尤其是Ser, Thr, Tyr, Lys, Arg, Cys等残基),通过酶促或非酶促的方式引入小分子基团、多肽或糖链等修饰单位。以下列举并解析几类在研究和临床中最具代表性的PTM类型及其作用机制:
1、磷酸化(Phosphorylation)
磷酸化是最为广泛研究的一种PTM,由蛋白激酶(kinase)催化,将ATP来源的磷酸基团转移至蛋白质的丝氨酸(Ser)、苏氨酸(Thr)或酪氨酸(Tyr)残基上,生成磷酸化肽段。该修饰高度动态,可被磷酸酶(phosphatase)可逆去除,构成一种基于开/关机制的调控系统。
这一修饰主导着绝大多数细胞内信号转导级联,如MAPK、PI3K-Akt、JAK-STAT等经典通路中,磷酸化事件驱动激酶活化、转录因子核转位、细胞周期调控等关键生物过程。因其反应速度快、放大效应强,磷酸化常被视为最核心的信息传递修饰形式。
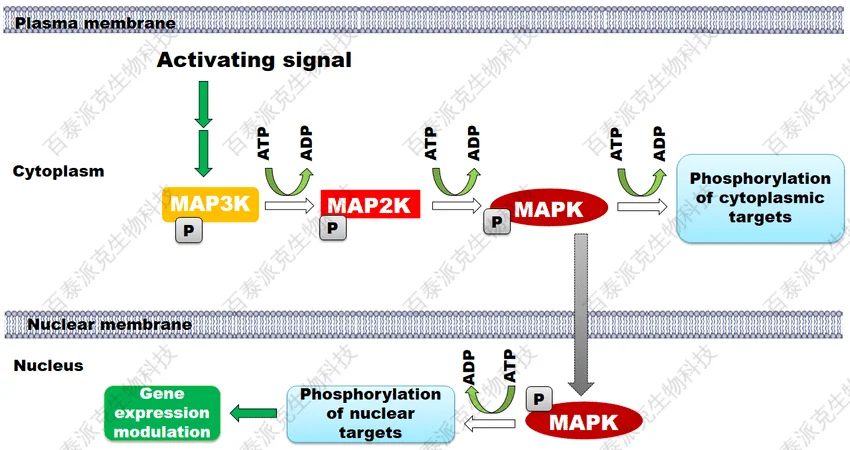
PLoS One. 2016 May 31;11(5)
MAPK 级联及其激活机制的示意图
质谱检测中,磷酸肽因带负电荷而需通过IMAC或TiO₂进行选择性富集;而位点定位常依赖于高分辨MS/MS数据中的中性丢失离子(如–98 Da)以及精确的b/y离子匹配。
2、乙酰化
乙酰化(acetylation)最早是在组蛋白上发现,后被证实广泛存在于非组蛋白蛋白质中。其核心功能在于调节赖氨酸残基正电荷,从而改变蛋白与DNA、蛋白与蛋白之间的静电相互作用。对组蛋白而言,这种修饰直接关系到染色质的开放程度和转录可及性,是表观遗传调控的基本符号。
但近年来,非组蛋白乙酰化逐渐成为研究焦点。在代谢酶、信号转导分子和结构蛋白中,乙酰化通过影响构象稳定性、酶活性甚至亚细胞定位而参与多层级调控。例如,p53的多位点乙酰化不仅增强其DNA结合能力,还调节其与泛素化系统之间的交叉调控,延长其半衰期,避免异常降解。
此外,乙酰化与能量代谢的连接尤为紧密。细胞内乙酰辅酶A浓度的波动可直接影响乙酰化水平,形成从代谢通量到表观状态的耦联通道。因此,乙酰化已不再只是“转录开关”,而是一种“代谢-表观信息中介”。
在质谱检测中,乙酰化肽段由于无电荷变化,识别难度大,需借助高亲和力的anti-acetyl-Lys抗体富集,常采用Lys-N或Trypsin酶解以保留关键修饰位点,定量推荐使用TMT或label-free策略。数据分析中需特别注意与其他修饰(如甲酰化、谷酰化)质量漂移接近所造成的定性混淆。
3、甲基化(Methylation)
与磷酸化或乙酰化不同,甲基化(methylation)并不引起电荷变化,其功能也更偏向于构建“稳定状态”。组蛋白甲基化是这一类别中研究最深的修饰类型,不同位点和甲基数目(mono-/di-/tri-methylation)对染色质结构与基因表达有着精确调控功能。例如,H3K4me3常作为启动子激活的标记,而H3K27me3则与沉默区域高度相关。
但甲基化的作用远不止于组蛋白。诸如转录因子、信号蛋白、RNA结合蛋白等非组蛋白甲基化事件,在细胞发育、胚胎分化和干细胞命运决定中逐渐显露其调控效应。一个值得关注的问题是,许多甲基化位点的生物学功能目前仍属未知,部分甲基化甚至可能作为“保护性封闭”标志而非功能激活,提示我们对其“功能性解读”仍处在初级阶段。
质谱上,甲基化修饰的质量变化小(+14.0157 Da),需精确区分单/双/三甲基状态。且修饰异构体之间谱图重叠严重,通常建议采用高分辨率MS和多重酶切验证,辅以抗甲基化抗体富集提高特异性。
4、泛素化与类泛素修饰
泛素化(ubiquitination)是指将76个氨基酸组成的小分子蛋白——泛素(ubiquitin)通过异肽键(isopeptide bond)共价连接至目标蛋白赖氨酸残基的过程。泛素化是最具“可塑性”的修饰类型之一。它既可作为蛋白质降解的直接标记,也能通过构建多种链型(K48、K63、K11、线性链等)参与细胞信号调控、DNA修复、膜转运乃至转录调控等过程。
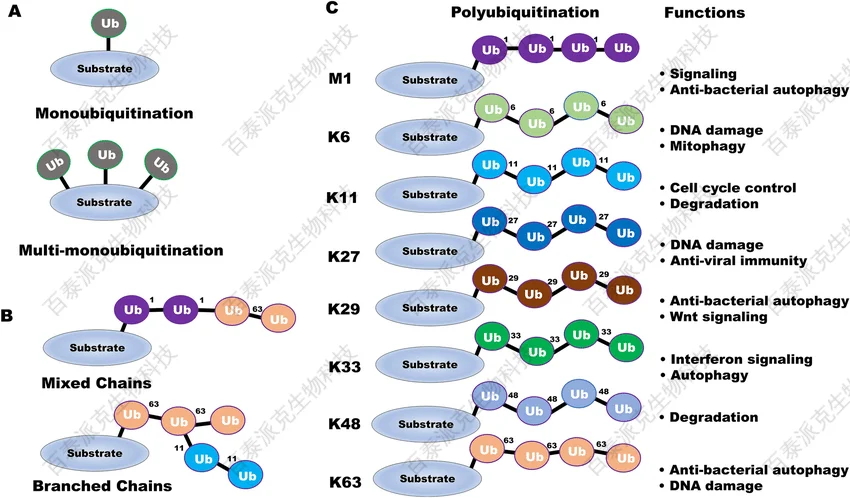
Apoptosis. 2022 Oct; 27(9-10):668-684
各种类型的泛素连接及相关功能
除泛素外,细胞中还存在一类结构相似、但功能侧重不同的“小泛素样蛋白”(Ubiquitin-like proteins, Ubls),包括:
● NEDD8:通过修饰Cullin蛋白调节泛素E3连接酶复合体(CRL)的活性
● ISG15:在抗病毒应答中表达上调,影响干扰素信号放大
与大多数小分子修饰不同,泛素为完整蛋白,其在样品酶解后留下一个典型的二肽残基(Gly-Gly),位于赖氨酸侧链上,产生+114.0429 Da的质量偏移。识别这类残基的关键在于:
● 使用K-ε-GG抗体富集特异性肽段
● 结合高分辨质谱(MS/MS)获得b/y离子精确定位
● 辅以多酶联合酶解(如Trypsin + Lys-C)提高修饰覆盖率
5、糖基化
糖基化(glycosylation)是唯一以“结构多样性”为功能基础的翻译后修饰类型。与磷酸化、乙酰化这类“功能性单点修饰”不同,糖基化的功能往往依赖于其糖链结构、长度、分支与位置的变化。
N-糖基化(Asn)与O-糖基化(Ser/Thr)在细胞表面蛋白、分泌蛋白和受体蛋白中广泛存在,调节其折叠效率、膜定位、免疫逃逸能力等。例如,PD-L1的N-糖基化增强其稳定性和膜表达,是肿瘤免疫抑制机制的一部分。糖链的改变也是肿瘤转化过程中的重要标志,如Tn抗原(O-GalNAc)在多种癌细胞中表达升高。
糖基化的最大挑战在于其异质性:同一糖基化位点可能存在数十种不同的糖型(glycoforms),这对检测与定量带来巨大压力。HILIC、PGC等色谱方法结合MSn技术是当前主流策略,但对于复杂糖型解析仍需多平台数据融合。
此外,糖基化研究高度依赖生物信息学注释,如GlycoWorkbench、Byonic中集成的糖链结构数据库,在非靶向检测中更是不可或缺。
6、新型修饰
随着高分辨率质谱(HR-MS)和靶向富集技术的发展,许多以往难以捕捉的新型翻译后修饰逐渐进入研究视野。这些修饰通常与代谢物直接相关,具有时间尺度快、调控范围广、对环境变化高度敏感的特征,成为连接细胞代谢状态与表观遗传程序之间的关键枢纽。以下是当前研究热点中数种具代表性的新型修饰:
(1)乳酸化(Lactylation)
乳酸化(Kla)(lactylation)是最具代表性的代谢型修饰,最早由Zhang等于2019年在组蛋白H3上发现,是由内源性L-乳酸供体通过酰基转移机制修饰赖氨酸侧链的过程。该修饰在缺氧、糖酵解增强(Warburg效应)、免疫应答等背景下显著上调,已被证实能够调控巨噬细胞极化(M1→M2)、干细胞命运和癌基因表达等过程。
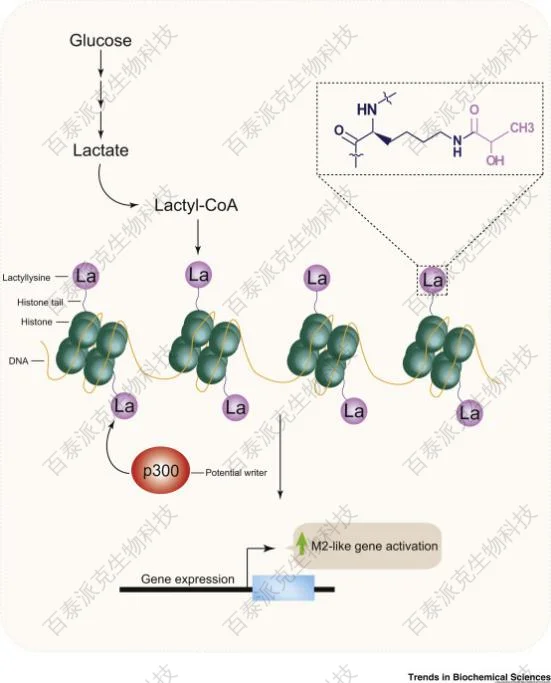
Trends Biochem Sci. 2020 Mar;45(3):179-182.
组蛋白乳酸化介导基因表达促进M2样表型
其机制表明乳酸不仅是代谢副产物,更是可直接参与调节染色质活性的信号分子。研究已发现组蛋白以外的非组蛋白靶点(如酶类、转录因子)也可发生乳酸化,提示其在转录调控与蛋白互作网络中发挥广泛功能。
检测难点:乳酸化肽段的质量偏移(+72.0211 Da)容易与其他修饰混淆,且靶点丰度极低,需结合特异性抗体富集与纳升LC-MS/MS检测。
(2)羟丁酰化(β-Hydroxybutyrylation, Kbhb)
β-羟丁酸(BHB)是饥饿、禁食或酮饮食条件下生成的主要酮体,它可在体内高浓度积累,并作为修饰底物引入赖氨酸侧链,形成β-羟丁酰化修饰。该修饰在肝脏、肌肉、脑组织中广泛存在,被认为是能量缺乏状态下表观转录程控的关键标志。
研究发现Kbhb可竞争乙酰化位点,进而抑制炎症基因表达(如NF-κB靶基因),提升氧化应激耐受性,是长寿、代谢健康等领域的重要关注对象。
技术挑战:Kbhb修饰的异构体较多,需通过高分辨MS及串联质谱碎片信息精细鉴定;结合SILAC标记或PRM/targeted MS有助于修饰定量。
(3)谷胱甘肽化(S-glutathionylation)
谷胱甘肽(GSH)是细胞内最主要的抗氧化小分子,其在氧化胁迫状态下可通过二硫键与蛋白质巯基形成混合二硫键(S-SG),即S-谷胱甘肽化。该修饰对保护重要酶类免受不可逆氧化、调控酶活性、传递ROS信号等具有重要意义。
S-glutathionylation通常发生在Cys残基上,具有可逆性,可被谷胱甘肽还原酶(GR)或硫氧还蛋白酶(Trx)系统去修饰。
质谱识别要点:修饰质量偏移为+305.0682 Da,因巯基反应活性高,样品制备需快速低温处理,避免假阳性。衍生化捕获策略(如Biotin-GSH)已逐步被用于富集低丰度修饰肽。
(4)乙酰谷氨酰化(Acetylglutarylation)、丙酰化(Propionylation)、丁酰化(Butyrylation)等:线粒体代谢衍生修饰
这些脂肪酸中间体衍生的修饰形式,广泛发生于线粒体内膜蛋白与代谢酶上。它们反映了细胞脂质代谢活动水平,并通过竞争赖氨酸乙酰化调节转录因子活性、染色质状态与细胞命运。例如,丁酰化已被报道可调控p53依赖性凋亡过程。
这些修饰均存在位点交叠、质量漂移重叠等识别难点,需结合特异富集策略与靶向碎片分析方法联合鉴定。
关于我们
北京百泰派克生物科技有限公司致力于为生物/制药和医疗器械行业提供质量控制检测和项目验证等专业服务。公司实验室遵循NMPA、ICH、FDA和EMA等的法规和指导原则,通过CNAS/ISO9001双重质量体系认证,建立了完备的质量体系,数据冷热/异地备份,设备定期计量/期间核查,软件审计追踪,为客户提供一体化解决方案和技术服务,支持新药研发、药物申报注册和生产放行。
1.公司采用ISO9001质量控制体系,专业提供以质谱为基础的CRO检测分析服务;
2.获国家CNAS实验室认可,为客户提供符合全球药政法规的药物质量研究服务;
3.业务范围覆盖蛋白质组学、多肽组学、代谢组学、生物药物表征、单细胞分析、单细胞质谱流式、生信云分析以及多组学生物质谱整合分析等;
4.七大质量控制检测平台,满足您一站式服务需求;
5.服务3000+企业,10000+客户的选择;
6.致力于为您提供优质的生物质谱分析服务!

